Qui a été le premier : le virus ou la cellule ?
Qui a été le premier : le virus ou la cellule ?
Abstract
Une rétrospective des débats sur l’origine de la vie : le virus ou la cellule ? Le virus a besoin de la cellule pour se répliquer, mais la cellule est une forme plus évoluée à l’échelle évolutive de la vie. Les virus semblent avoir joué un rôle dans des événements tels que l’origine de la vie cellulaire et l’évolution des mammifères. Même la bactérie la plus simple est bien trop complexe pour être apparue spontanément au début de l’évolution. Par la suite, l’évolution a pu produire des systèmes de plus en plus complexes. La première vraie cellule doit déjà avoir été un produit de l’évolution, résultant d’une communauté primordiale.
Qui a été le premier : le virus ou la cellule ?
Les virus se reproduisent uniquement à l’intérieur des cellules vivantes des organismes, (Wu 2020) étant connu à ce jour plus de 6000 espèces de virus. (International Committee on Taxonomy of Viruses (ICTV) 2020) Lorsqu’il infecte une cellule, les virus la forcent à produire rapidement des milliers de copies identiques du virus original.
Une idée fausse relativement courante sur ce qu’est réellement un virus biologique est qu’un virus se réfère souvent uniquement à des capsules protectrices constituées de protéines, qui contiennent des informations génomiques virales dans l’environnement extracellulaire. (Jacob et Wollman 1961) Cette particule est un virion et est généralement considérée comme morte. Matti Jalasvuori (Jalasvuori 2012) met en évidence la différence entre un virus et un virion, ce qui nous permet d’apprécier les virus comme des acteurs évolutifs ou même comme des organismes vivants. (Forterre et Prangishvili 2009)
Les virions sont des virus externes et autonomes constitués de matériel génétique (molécules d’ADN ou d’ARN) qui codent la structure des protéines, une couche protéique (capside) et parfois une couche externe de lipides.
Les virus sont beaucoup trop petits pour être visualisés avec un microscope ordinaire, avec des diamètres compris entre 20 et 300 nanomètres. (Mahy 1998) Les premières images ont été obtenues par microscopie électronique en 1931 par les ingénieurs allemands Ernst Ruska et Max Knoll. (Fraengsmyr et Ekspong 1993) Rosalind Franklin a découvert la structure complète du virus en 1955. (Creager et Morgan 2008)
Les virus semblent avoir joué un rôle dans des événements tels que l’origine de la vie cellulaire (Koonin, Senkevich, et Dolja 2006) et l’évolution des mammifères. (Gifford 2012)
L’origine des virus n’est pas claire (ils existent depuis la première évolution des cellules vivantes. (Iyer et al. 2006) Trois hypothèses principales expliquent l’origine des virus: (Shors 2016)
- L’hypothèse régressive (« hypothèse de dégénérescence » (Dimmock, Easton, et Leppard 2007) ou « hypothèse de réduction » : (Mahy et Regenmortel 2009) proviennent de petites cellules qui parasitaient auparavant des cellules plus grandes.
- L’hypothèse d’origine cellulaire (« hypothèse errante ») (Mahy 1998) ou « hypothèse d’échappement » : (Mahy et Regenmortel 2009) proviennent de morceaux d’ADN ou d’ARN qui se sont « échappés » des gènes d’un organisme plus grand. (Shors 2016)
- L’hypothèse de coévolution (« hypothèse du premier virus » : (Mahy et Regenmortel 2009) provient de molécules complexes de protéines et d’acide nucléique se produisant simultanément avec les cellules dont elles auraient été dépendantes.
Une hypothèse prétend que les virus sont probablement apparus plusieurs fois dans le passé par un ou plusieurs mécanismes. (Mahy et Regenmortel 2009)
Même la bactérie la plus simple est bien trop complexe pour être apparue spontanément au début de l’évolution. Par la suite, l’évolution a pu produire des systèmes de plus en plus complexes. Matti Jalasvuori conclut que la première vraie cellule doit déjà avoir été un produit de l’évolution, (Jalasvuori 2012) résultant d’une communauté primordiale. (Doolittle 2000) La communauté aurait évolué principalement horizontalement en changeant les informations génétiques entre les protocellules, plutôt que d’une manière « darwinienne », en passant les gènes verticalement à la progéniture. (Koonin et Martin 2005) Il s’ensuit que les protocellules elles-mêmes n’étaient pas des entités génétiques cohérentes, mais des collections plus ou moins aléatoires de réplicateurs génétiques indépendants, qui ont évolué collectivement, maintenant ainsi le code génétique commun. (Vetsigian, Woese, et Goldenfeld 2006) Comme on pense que les virus ou les réplicateurs de type virus sont capables de créer de nouveaux gènes, ils auraient pu être l’un des éléments de cette communauté primordiale.
Matti Jalasvuori déclare que les virus fournissent une explication possible à l’évolution horizontale du début de la vie, car les virions sont essentiellement des structures génétiquement codées qui interviennent dans le transfert de cellule à cellule de l’information génétique. À mesure que le système principal progressait, certains des premiers virus ont établi une résidence permanente dans certains des protocoles. (Jalasvuori 2012)
Scott Podolsky (Podolsky 1996) a décrit les différents rôles des virus dans la théorie de l’origine de la vie des années 1920 aux années 1960 (Kostyrka 2016) contrairement à une « approche cytoplasmique ». L’approche nucléo-centrique a défini la vie basée sur l’auto-duplication. (Podolsky 1996, 80) L’approche cytoplasmique s’est concentrée sur le cytoplasme comme modèle pour définir la vie et comprendre son origine, conçue comme autorégulation.
Podolsky a identifié trois rôles principaux des virus dans les scénarios d’origine précoce : en tant que « métaphore » de la vie (conceptualisée comme image de la vie primitive), en tant que « modèle opérationnel » (fournit, par analogie, une représentation conceptuelle des mécanismes possibles), et leur rôle phylogénétique, conférant des arguments nucléo-centriques centrés sur le virus avec un vrai « sens de l’historicité ». (Podolsky 1996, 84) Ainsi, les virus pourraient être considérés comme « des descendants relativement inchangés du précurseur primordial de toutes les formes de vie ultérieures ». (Podolsky 1996, 84)
Selon Gladys Kostyrka dans What roles for viruses in origin of life scenarios?, (Kostyrka 2016) la conceptualisation des virus en tant que produits inertes de cellules vivantes ou d’agents extracellulaires avait de fortes implications sur les rôles que les virus pourraient jouer dans les scénarios d’origine de la vie. La divergence entre un « style de pensée endogène » et un « style de pensée exogène » a été particulièrement forte dans les débats. Félix d’Hérelle (Félix d’ Hérelle 1926) a proposé un scénario viro-centrique de l’origine de la vie. Pour d’Hérelle, les virus ne sont pas des formes de vie primitives (F. d’Hérelle 1928, 540) car ce sont des parasites des cellules. Mais les virus pourraient représenter des descendants relativement inchangés de formes de vie primitives (rôle phylogénétique), et pourraient également servir de métaphore de la vie (rôle métaphorique). (F. d’Hérelle 1928, 538) Sur la base d’une métaphore virale de la vie, d’ Hérelle a émis l’hypothèse que les formes de vie les plus simples ne sont pas cellulaires, mais micellaires.
Le scénario proposé par Alexander et Brigdes en 1928 diffère à bien des égards du scénario d’Hérelle. (Alexander et Bridges 1928) Leur approche est nucléo centrique, car ils conçoivent le virus comme un exemple de vie. Ils considèrent les virus comme des simples formes de vie (« ultrabionts »), mais plus complexes que les fondamentales (« moléculobionts »).
B. S. Haldane a fourni un autre exemple de conception de la vie qui, comme d’ Hérelle, n’est pas strictement nucléo centrique, mais donne néanmoins aux virus un rôle important dans l’origine de la vie. Mais Haldane a refusé d’appeler les virus « vivants » et les a plutôt décrits comme des modèles pour comprendre les premières « molécules à moitié vivantes » (Haldane 1929) qui auraient pu exister avant la formation de la première cellule.
Les rôles phylogénétiques des virus ont été particulièrement contestés. Les virus seraient plutôt le résultat de l’évolution réductrice des cellules. (Laidlaw 2014) L’hypothèse Green-Laidlaw ou l’hypothèse rétrograde de l’origine des virus a convaincu de nombreux biologistes. (Podolsky 1996, 101‑3)
Les hypothèses sur l’origine de la vie due aux virus se sont multipliées dans les années 2000 et 2010. (Koonin et Dolja 2013) Selon Gladys Kostyrka, (Kostyrka 2016) le syllogisme suivant serait probablement accepté par de nombreux biologistes:
- Les virus dépendent des cellules (aucun virus n’aurait pu exister avant les cellules),
- La recherche de l’origine de la vie consiste à retracer l’apparition de la première cellule,
- Les virus sont donc exclus des discussions sur les origines de la vie.
Ce syllogisme semble entraver le rôle phylogénétique ou historique des virus dans les origines de la vie. Cependant, Patrick Forterre (Forterre 2006) a émis l’hypothèse que les virus sont apparus avant les cellules à ADN et avant le dernier ancêtre commun universel (DACU), ce qui a entraîné un rôle phylogénétique pour les virus. Selon Forterre, les virus ancestraux n’ont pas contribué à l’émergence de la vie cellulaire ; la vie cellulaire doit avoir existé avant, car les virus ont besoin de cellules pour se répliquer. Mais les virus auraient contribué à l’origine des cellules d’ADN. Une version simplifiée du scénario d’apparition de l’ADN est que les virus à ARN sont apparus dans la deuxième ère du monde de l’ARN, car les cellules à ARN existaient déjà et pourraient être parasitées. (Kostyrka 2016) (Forterre 2005)
La confirmation du rôle phylogénétique des virus pourrait donc expliquer la coexistence problématique de deux modes distincts de réplication de l’ADN dans le monde vivant. Ce scénario donne également aux virus un rôle opérationnel. Les virus, pour Forterre, ont des rôles phylogénétiques et opérationnels, mais ils ne sont pas des métaphores de la vie primitive. (Forterre 2016)
Eugène Koonin développe un scénario viro-centrique de l’origine de la vie (« le scénario du monde du virus primordial ». (Koonin 2009) Koonin suppose également que les virus sont apparus au cours du deuxième monde de l’ARN, mais rejette l’existence présumée de cellules à ARN, principalement en raison de l’instabilité de l’ARN. (Koonin, Senkevich, et Dolja 2006, 10) Il a fait valoir que les premières cellules devaient être des cellules d’ADN, de sorte que les virus ont dû apparaître dans un monde sans cellules. Ainsi, Koonin rejette l’hypothèse courante selon laquelle les virus ne peuvent exister sans cellules. (Koonin et Dolja 2013, 550) En 2006, Koonin a formulé « l’hypothèse du monde viral ancien » selon laquelle aucun gène n’est partagé par toutes les espèces virales – il n’y a pas d’ancêtre commun à tous les virus, les virus ont des origines multiples. Pour expliquer la présence de ces gènes dans les virus existants, Koonin suppose qu’ils proviennent d’un monde viral primordial et ont été conservés. (Koonin 2009, 60)
Koonin soutient que le rôle phylogénétique de permettre le passage de l’ARN à l’ADN n’est pas attribué seulement aux virus. (Koonin et Dolja 2014, 289) Il attribue un rôle phylogénétique à tous les composants des virus. Dans une certaine mesure, cette hypothèse fournit également une métaphore de la vie. (Koonin et Martin 2005)
L’originalité du scénario viro-centrique de Koonin repose sur la conception sous-jacente des virus. Contrairement à Forterre, Koonin soutient que les virus peuvent exister et se répliquer sans cellules. Ainsi, Koonin conteste également la prémisse 1 du syllogisme. De plus, le monde viral « n’est en aucun cas limité aux virus typiques qui codent pour la capside ». (Koonin et Dolja 2013)
Gladys Kostyrka conclut que Forterre et Koonin soutiennent tous deux des analogies possibles entre les voies réelles de réplication virale et celles qui ont pu exister dans les premiers stades de la vie, et que les virus ont joué un rôle phylogénétique important dans l’apparition de l’ADN et, plus généralement, dans l’évolution des mécanismes de réplication. Mais Forterre affirme que les virus ne pourraient exister que s’il y avait des cellules, car les virus sont des parasites intracellulaires. Ainsi, le rôle phylogénétique des virus aurait eu lieu après l’apparition de la vie cellulaire. Au contraire, la conception Koonin des virus contredit la définition des virus comme parasites intracellulaires. Pour Koonin, les virus sont des éléments génétiques fondamentalement égoïstes entourés d’une capside. (Kostyrka 2016)
Comment le virus pourrait-il jouer un rôle dans l’apparition de la vie si l’existence des cellules est une condition préalable à l’existence de virus ? Gladys Kostyrka propose plusieurs stratégies. Une première stratégie importante pour introduire des virus dans des scénarios vitaux consiste à définir la vie comme cellulaire. Une stratégie très différente pour introduire des virus dans des scénarios d’origine vitale est basée sur la redéfinition de la vie cellulaire. (Kostyrka 2016)
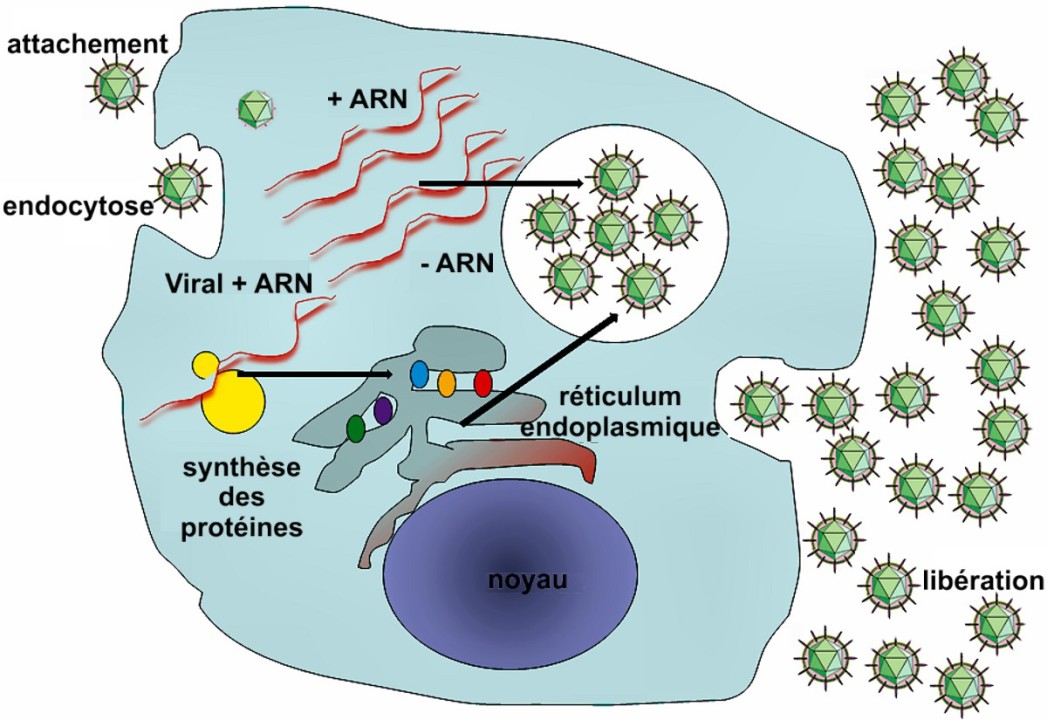
(Un cycle typique de réplication virale.)
Il y a six étapes de base dans la réplication du virus :(Mahy 1998)
- Attachement : liaison entre les protéines de capside virale et des récepteurs spécifiques à la surface de la cellule hôte. (Más et Melero 2013)
- Pénétration : les virions pénètrent dans la cellule hôte par endocytose médiée par un récepteur ou fusion membranaire. (Dimmock, Easton, et Leppard 2007)
- Dévoilement : retirez la capside virale. (Blaas 2016)
- Réplication virale : multiplication du génome. (Isomura et Stinski 2013)
- Assemblage : une modification des protéines (maturation) se produit après la libération du virus de la cellule hôte. (Barman et al. 2001)
- Libération : par lyse, un processus qui tue généralement la cellule en brisant la membrane et la paroi cellulaire. (Dimmock, Easton, et Leppard 2007)
Les virus facilitent le transfert horizontal de gènes, augmentant la diversité génétique. (Canchaya et al. 2003) Il y a un débat en cours sur la mesure dans laquelle les virus sont une forme de vie, ou sont des “organismes vivants” (Rybicki 1990) et des auto-réplicateurs. (Koonin et Starokadomskyy 2016)
Les virus subissent des changements génétiques à travers plusieurs mécanismes. Dans la dérive antigénique (lorsqu’il y a un changement majeur dans le génome du virus), les bases individuelles de l’ADN ou de l’ARN se déplacent vers d’autres bases – ces changements peuvent conférer des avantages évolutifs, tels que la résistance aux médicaments antiviraux. (Sandbulte et al. 2011) Lorsqu’ils peuvent être le résultat d’une recombinaison ou d’un réassortiment, les virus grippaux peuvent provoquer des pandémies. (Hampson et Mackenzie 2006) Les virus à ARN existent souvent sous forme de quasi-espèces ou d’essaims de virus de la même espèce, mais avec des séquences nucléosidiques du génome légèrement différentes. Ces quasi-espèces sont une cible majeure de la sélection naturelle. (Metzner 2006) Lors de la recombinaison génétique, un ADN est cassé puis joint à l’extrémité d’une molécule d’ADN différente. La recombinaison se produit généralement lorsque les virus infectent les cellules simultanément. (Worobey et Holmes 1999)
De nombreux organismes abritent une variété de gènes inconnus de la science. (Mocali et Benedetti 2010) Beaucoup de ces nouveaux gènes se trouvent dans les génomes viraux. (Yin et Fischer 2008)
Les virus pourraient être considérés comme des modificateurs génétiques. Les virus eux-mêmes n’évoluent pas, mais sont évolués par les cellules. (Moreira et Lopez-Garcia 2009) Mais de nombreux gènes viraux ne semblent pas avoir d’homologues cellulaires. (Yin et Fischer 2008) Les virus semblent avoir des gènes qui produisent des protéines structurellement et fonctionnellement conservées qui n’ont aucun ancêtre cellulaire apparent. (Keller et al. 2009)
Les infections virales provoquent généralement une réponse immunitaire qui tue le virus. Ces réponses immunitaires peuvent être déclenchées par des vaccins spécifiques. Il existe des virus, comme ceux qui causent le SIDA, et l’hépatite virale, qui parviennent à prévenir ces réponses immunitaires en provoquant des infections chroniques.
Certains virus ne provoquent pas de changements apparents dans la cellule asymptomatique infectée (Sinclair 2008) (latence), une caractéristique des virus de l’herpès. (Whitley et Roizman 2001) Ces virus latents peuvent parfois être bénéfiques, augmentant l’immunité contre les bactéries pathogènes. (Barton et al. 2007) D’autres infections persistent tout au long de la vie, (Bertoletti et Gehring 2007) de sorte que les personnes infectées sont appelées porteurs parce qu’elles servent de réservoirs de virus infectieux. (Rodrigues et al. 2001)
La transmission du virus peut être verticale (par exemple, de mère à enfant) ou horizontale (de personne à personne). La transmission horizontale est le mécanisme le plus courant de propagation du virus. (Antonovics et al. 2017) L’épidémiologie est utilisée pour briser la chaîne d’infection dans les populations lors d’épidémies de maladies virales, (Shors 2016) connaissant la source de l’épidémie et identifiant le virus. L’interruption peut se faire par le biais de vaccins ou d’isolement (quarantaine), d’assainissement et de désinfection. Les vaccins peuvent être constitués de virus atténués ou de protéines virales (antigènes). (Palese 2006)
Matti Jalasvuori souligne que, bien que les infections virales puissent rendre l’hôte résistant aux infections ultérieures par des types de virus similaires, il ne s’agit pas d’une symbiose héréditaire. Nous sommes immunisés contre la varicelle après une infection, mais nos enfants doivent encore s’infecter pour devenir résistants. (Jalasvuori 2012)
Lors de la propagation d’une épidémie virale, cette intégration d’un virus dans les cellules germinales pourrait être un avantage pour une personne. (Jern et Coffin 2008) Il est possible pour le virus d’établir une relation mutuellement bénéfique avec son hôte. Ce partenariat symbiotique existerait principalement au niveau de l’information génétique, (Ryan 2009) mais peut encore se produire à travers une fusion de deux entités distinctes de reproduction génétique. Bien que les virus puissent être considérés comme formant des relations symbiotiques par n’importe quel mécanisme, Matti Jalasvuori met en évidence certains aspects intéressants : comment ce virus intégré affecte-t-il l’évolution ultérieure de leurs hôtes ? Le virus endogène modifie la composition génétique des chromosomes et peut, par exemple, réguler l’expression des gènes de l’hôte. (Jern et Coffin 2008) Certains gènes dérivés semblent être restés actifs pendant des dizaines de millions d’années. (Katzourakis et Gifford 2010) Mais même dans ce cas, il est difficile de dire avec certitude l’importance de ces virus dans l’évolution de leurs hôtes. (Jalasvuori 2012)
Les virus sont un moyen naturel important de transfert de gènes entre différentes espèces, augmentant la diversité génétique et aidant à l’évolution, (Canchaya et al. 2003) étant considérés comme l’un des plus grands réservoirs de diversité génétique inexplorée sur Terre. (Suttle 2007) Ils peuvent également être utilisés pour manipuler et étudier les fonctions cellulaires, (Mahy 1998) étant utilisés comme vecteurs pour introduire des gènes dans les cellules étudiées. La virothérapie utilise des virus comme vecteurs pour traiter diverses maladies, y compris le traitement du cancer et la thérapie génique. (Jefferson, Cadet, et Hielscher 2015)
(Image avec microscope électronique transmettant un virus de la grippe recréé à partir de 1918)
De nombreux virus peuvent être synthétisés « à partir de zéro ». Le premier virus synthétique a été créé en 2002. (Cello, Paul, et Wimmer 2002) Cette technologie est utilisée pour étudier de nouvelles stratégies de vaccination. (Coleman et al. 2008) Il s’ensuit que les virus ne peuvent plus être considérés comme éteints, tant que leurs informations sur la séquence du génome sont connues et que des cellules permissives sont disponibles.
La capacité des virus à provoquer des épidémies a suscité des inquiétudes quant à la possibilité de leur utilisation dans une guerre biologique. Le virus de la grippe de 1918 a été recréé récemment avec succès dans un laboratoire. (Zilinskas 2017) Il n’y a que deux centres dans le monde autorisés par l’OMS à stocker des stocks de virus de la variole, qui peuvent être utilisés comme une arme car le vaccin contre la variole a parfois eu des effets secondaires graves et n’est plus couramment utilisé dans aucun pays. (Artenstein et Grabenstein 2008)
Stephan Guttinger, dans A Virus Is Not a Thing, Part 2: Do viruses jump? Process-thinking and the question of pandemics, affirme que les virus actifs peuvent avoir des effets positifs, par exemple en aidant le système immunitaire à se défendre contre les bactéries pathogènes. Les virus ont également joué un rôle important dans l’évolution, générant de nouvelles séquences génomiques et aidant à créer les premières cellules. (Guttinger 2020)
Thomas Pradeu, dans Mutualistic virus and the heteronomy of life, met en évidence les effets bénéfiques des virus mutualistes, (Roossinck 2011) suggérant une « reconceptualisation plus générale des virus, à l’interface entre les approches médicale et écologico-évolutionniste ». (Pradeu 2016)
William C. Summers a noté que « L’idée de base selon laquelle les virus sont la base matérielle de la transmission de la maladie a peu changé au cours des 150 dernières années ; ce qui a changé, c’est notre compréhension des propriétés essentielles et des capacités biologiques des virus. » (Summers 2014) Des recherches récentes ont montré que de nombreux virus sont neutres (n’affectent pas la condition physique de l’hôte) ou même mutualistes (améliorent la condition physique de l’hôte). (Cadwell 2015) L’effet positif des virus mutualistes peut se manifester dans le développement, la protection et l’invasion de l’hôte. (Pradeu 2016)
Concernant le développement de l’hôte, Pradeu discute du rôle des rétrovirus endogènes dans l’évolution du placenta chez les mammifères au cours de leur évolution (Dupressoir et al. 2009) et lors d’événements évolutifs significatifs. Pour protéger l’hôte, Pradeu spécifie l’amélioration de la capacité de l’hôte à se protéger des agents pathogènes ou des maladies (par exemple, chez l’homme, le SIDA progresse beaucoup plus lentement chez les patients infectés par le flavivirus GB, (Bhattarai et Stapleton 2012) et les bactériophages adhérant à la couche du mucus intestinal confère à leurs hôtes animaux une immunité contre les bactéries pathogènes. (Barr et al. 2013) Concernant l’effet mutualiste sur la capacité d’invasion de l’hôte, il s’agit de la capacité d’invasion de l’hôte, c’est-à-dire la capacité des virus à coloniser de nouveaux territoires au détriment des spécificités d’envahir leur propre hôte, (Bossi et al. 2003) ce phénomène peuvent avoir été un moteur important dans l’histoire de l’humanité (dix ans après l’invasion européenne, 90% des amérindiens étaient morts, peut-être due à des virus). (Bianchine et Russo 1992)
Pradeu conclut qu’il n’est plus approprié de considérer les virus comme généralement nocifs. De nombreux virus ne peuvent être classés comme « mutualistes » ou « pathogènes » car leurs interactions avec l’hôte peuvent changer d’un état à l’autre. Il y a un changement dans la façon dont les scientifiques recherchent de nouveaux virus et un changement dans la façon dont notre système immunitaire hôte interagit avec les microbes. À cet égard, de nouvelles approches thérapeutiques ont été développées, grâce à la virothérapie (par exemple, la phagothérapie, la manipulation de co-infections en stimulant (ou en maintenant) un virus particulier pour combattre ou contrôler un pathogène, ou l’utilisation de virus qui peuvent tuer cellules tumorales, appelées « virus oncolytiques ». (Burke et al. 2015)
Bibliografie
- Alexander, J., et C. B. Bridges. 1928. « Some physico-chemical aspects of life, mutation, and evolution ». Biology and medicine II: 9‑58.
- Antonovics, Janis, Anthony J. Wilson, Mark R. Forbes, Heidi C. Hauffe, Eva R. Kallio, Helen C. Leggett, Ben Longdon, Beth Okamura, Steven M. Sait, et Joanne P. Webster. 2017. « The Evolution of Transmission Mode ». Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences 372 (1719). https://doi.org/10.1098/rstb.2016.0083.
- Artenstein, Andrew W., et John D. Grabenstein. 2008. « Smallpox Vaccines for Biodefense: Need and Feasibility ». Expert Review of Vaccines 7 (8): 1225‑37. https://doi.org/10.1586/14760584.7.8.1225.
- Barman, Subrata, Ayub Ali, Eric K. -W. Hui, Lopa Adhikary, et Debi P. Nayak. 2001. « Transport of Viral Proteins to the Apical Membranes and Interaction of Matrix Protein with Glycoproteins in the Assembly of Influenza Viruses ». Virus Research 77 (1): 61‑69. https://doi.org/10.1016/S0168-1702(01)00266-0.
- Barr, Jeremy J., Rita Auro, Mike Furlan, Katrine L. Whiteson, Marcella L. Erb, Joe Pogliano, Aleksandr Stotland, et al. 2013. « Bacteriophage Adhering to Mucus Provide a Non-Host-Derived Immunity ». Proceedings of the National Academy of Sciences of the United States of America 110 (26): 10771‑76. https://doi.org/10.1073/pnas.1305923110.
- Barton, Erik S., Douglas W. White, Jason S. Cathelyn, Kelly A. Brett-McClellan, Michael Engle, Michael S. Diamond, Virginia L. Miller, et Herbert W. Virgin. 2007. « Herpesvirus Latency Confers Symbiotic Protection from Bacterial Infection ». Nature 447 (7142): 326‑29. https://doi.org/10.1038/nature05762.
- Bertoletti, Antonio, et Adam Gehring. 2007. « Immune Response and Tolerance during Chronic Hepatitis B Virus Infection ». Hepatology Research 37 (s3): S331‑38. https://doi.org/10.1111/j.1872-034X.2007.00221.x.
- Bhattarai, Nirjal, et Jack T. Stapleton. 2012. « GB Virus C: The Good Boy Virus? » Trends in Microbiology 20 (3): 124‑30. https://doi.org/10.1016/j.tim.2012.01.004.
- Bianchine, P. J., et T. A. Russo. 1992. « The Role of Epidemic Infectious Diseases in the Discovery of America ». Allergy Proceedings: The Official Journal of Regional and State Allergy Societies 13 (5): 225‑32. https://doi.org/10.2500/108854192778817040.
- Blaas, Dieter. 2016. « Viral Entry Pathways: The Example of Common Cold Viruses ». Wiener Medizinische Wochenschrift 166 (7): 211‑26. https://doi.org/10.1007/s10354-016-0461-2.
- Bossi, Lionello, Juan A. Fuentes, Guido Mora, et Nara Figueroa-Bossi. 2003. « Prophage Contribution to Bacterial Population Dynamics ». Journal of Bacteriology 185 (21): 6467‑71. https://doi.org/10.1128/jb.185.21.6467-6471.2003.
- Burke, James, Jorge Nieva, Mitesh J. Borad, et Caroline J. Breitbach. 2015. « Oncolytic Viruses: Perspectives on Clinical Development ». Current Opinion in Virology 13 (août): 55‑60. https://doi.org/10.1016/j.coviro.2015.03.020.
- Cadwell, Ken. 2015. « The Virome in Host Health and Disease ». Immunity 42 (5): 805‑13. https://doi.org/10.1016/j.immuni.2015.05.003.
- Canchaya, Carlos, Ghislain Fournous, Sandra Chibani-Chennoufi, Marie-Lise Dillmann, et Harald Brüssow. 2003. « Phage as Agents of Lateral Gene Transfer ». Current Opinion in Microbiology 6 (4): 417‑24. https://doi.org/10.1016/S1369-5274(03)00086-9.
- Cello, Jeronimo, Aniko V. Paul, et Eckard Wimmer. 2002. « Chemical Synthesis of Poliovirus CDNA: Generation of Infectious Virus in the Absence of Natural Template ». Science (New York, N.Y.) 297 (5583): 1016‑18. https://doi.org/10.1126/science.1072266.
- Coleman, J. Robert, Dimitris Papamichail, Steven Skiena, Bruce Futcher, Eckard Wimmer, et Steffen Mueller. 2008. « Virus Attenuation by Genome-Scale Changes in Codon Pair Bias ». Science (New York, N.Y.) 320 (5884): 1784‑87. https://doi.org/10.1126/science.1155761.
- Creager, Angela N. H., et Gregory J. Morgan. 2008. « After the Double Helix ». Isis 99 (2): 239‑72. https://doi.org/10.1086/588626.
- Dimmock, Nigel J., Andrew J. Easton, et Keith N. Leppard. 2007. Introduction to Modern Virology. 6th Edition. Malden, MA: Wiley-Blackwell.
- Doolittle, W. F. 2000. « The Nature of the Universal Ancestor and the Evolution of the Proteome ». Current Opinion in Structural Biology. Curr Opin Struct Biol. juin 2000. https://doi.org/10.1016/s0959-440x(00)00096-8.
- Dupressoir, Anne, Cécile Vernochet, Olivia Bawa, Francis Harper, Gérard Pierron, Paule Opolon, et Thierry Heidmann. 2009. « Syncytin-A Knockout Mice Demonstrate the Critical Role in Placentation of a Fusogenic, Endogenous Retrovirus-Derived, Envelope Gene ». Proceedings of the National Academy of Sciences of the United States of America 106 (29): 12127‑32. https://doi.org/10.1073/pnas.0902925106.
- Forterre, Patrick. 2005. « The Two Ages of the RNA World, and the Transition to the DNA World: A Story of Viruses and Cells ». Biochimie. Biochimie. octobre 2005. https://doi.org/10.1016/j.biochi.2005.03.015.
- ———. 2006. « The Origin of Viruses and Their Possible Roles in Major Evolutionary Transitions ». Virus Research. Virus Res. avril 2006. https://doi.org/10.1016/j.virusres.2006.01.010.
- ———. 2016. « To Be or Not to Be Alive: How Recent Discoveries Challenge the Traditional Definitions of Viruses and Life ». Studies in History and Philosophy of Biological and Biomedical Sciences. Stud Hist Philos Biol Biomed Sci. octobre 2016. https://doi.org/10.1016/j.shpsc.2016.02.013.
- Forterre, Patrick, et David Prangishvili. 2009. « The Origin of Viruses ». Research in Microbiology 160 (7): 466‑72. https://doi.org/10.1016/j.resmic.2009.07.008.
- Fraengsmyr, Tore, et Goesta Ekspong. 1993. « Nobel lectures in physics 1981-1990 ». Singapore: World Scientific, |c1993, edited by Fraengsmyr, Tore; Ekspong, Goesta. http://adsabs.harvard.edu/abs/1993nlp..book…..F.
- Gifford, Robert J. 2012. « Viral Evolution in Deep Time: Lentiviruses and Mammals ». Trends in Genetics: TIG 28 (2): 89‑100. https://doi.org/10.1016/j.tig.2011.11.003.
- Guttinger, Stephan. 2020. « A Virus Is Not a Thing, Part 2: Do Viruses Jump? Process-Thinking and the Question of Pandemics ». Philosophy, Logic and Scientific Method (blog). 22 juillet 2020. https://www.lse.ac.uk/philosophy/blog/2020/07/22/a-virus-is-not-a-thing-2/.
- Haldane, J. B. S. 1929. « The origin of life ». The Rationalist Annual, no 148: 3‑10.
- Hampson, Alan W., et John S. Mackenzie. 2006. « The Influenza Viruses ». Medical Journal of Australia 185 (S10): S39‑43. https://doi.org/10.5694/j.1326-5377.2006.tb00705.x.
- Hérelle, F. d’. 1928. « Bacteriophage, a living colloidal micell ». Colloid chemistry, theoretical and applied II: 535‑41.
- Hérelle, Félix d’ . 1926. « Le bactériophage et son comportement. (Book, 1926) [WorldCat.org] ». 1926. https://www.worldcat.org/title/bacteriophage-et-son-comportement/oclc/11981307.
- International Committee on Taxonomy of Viruses (ICTV). 2020. « Virus Taxonomy: 2019 Release ». 2020. https://talk.ictvonline.org/taxonomy/.
- Isomura, H., et M Stinski. 2013. « Coordination of Late Gene Transcription of Human Cytomegalovirus with Viral DNA Synthesis: Recombinant Viruses as Potential Therapeutic Vaccine Candidates ». Expert Opinion on Therapeutic Targets. Expert Opin Ther Targets. février 2013. https://doi.org/10.1517/14728222.2013.740460.
- Iyer, Lakshminarayan M., S. Balaji, Eugene V. Koonin, et L. Aravind. 2006. « Evolutionary Genomics of Nucleo-Cytoplasmic Large DNA Viruses ». Virus Research, Comparative Genomics and Evolution of Complex Viruses, 117 (1): 156‑84. https://doi.org/10.1016/j.virusres.2006.01.009.
- Jacob, F., et E. L. Wollman. 1961. « Viruses and Genes ». Scientific American 204 (juin): 93‑107.
- Jalasvuori, Matti. 2012. « Viruses: Essential Agents of Life ». ResearchGate. 2012. https://www.researchgate.net/publication/278720857_Viruses_Essential_Agents_of_Life.
- Jefferson, Artrish, Valerie E. Cadet, et Abigail Hielscher. 2015. « The Mechanisms of Genetically Modified Vaccinia Viruses for the Treatment of Cancer ». Critical Reviews in Oncology/Hematology 95 (3): 407‑16. https://doi.org/10.1016/j.critrevonc.2015.04.001.
- Jern, Patric, et John M. Coffin. 2008. « Effects of Retroviruses on Host Genome Function ». Annual Review of Genetics 42: 709‑32. https://doi.org/10.1146/annurev.genet.42.110807.091501.
- Katzourakis, Aris, et Robert J. Gifford. 2010. « Endogenous Viral Elements in Animal Genomes ». PLoS Genetics 6 (11): e1001191. https://doi.org/10.1371/journal.pgen.1001191.
- Keller, J., N. Leulliot, N. Soler, B. Collinet, R. Vincentelli, P. Forterre, et H. van Tilbeurgh. 2009. « A Protein Encoded by a New Family of Mobile Elements from Euryarchaea Exhibits Three Domains with Novel Folds ». Protein Science: A Publication of the Protein Society 18 (4): 850‑55. https://doi.org/10.1002/pro.73.
- Koonin, Eugene V. 2009. « On the Origin of Cells and Viruses: Primordial Virus World Scenario ». Annals of the New York Academy of Sciences 1178 (1): 47. https://doi.org/10.1111/j.1749-6632.2009.04992.x.
- Koonin, Eugene V., et Valerian V. Dolja. 2013. « A Virocentric Perspective on the Evolution of Life ». Current Opinion in Virology 3 (5): 546. https://doi.org/10.1016/j.coviro.2013.06.008.
- ———. 2014. « Virus World as an Evolutionary Network of Viruses and Capsidless Selfish Elements ». Microbiology and Molecular Biology Reviews : MMBR 78 (2): 278‑303. https://doi.org/10.1128/MMBR.00049-13.
- Koonin, Eugene V., et William Martin. 2005. « On the Origin of Genomes and Cells within Inorganic Compartments ». Trends in Genetics: TIG 21 (12): 647‑54. https://doi.org/10.1016/j.tig.2005.09.006.
- Koonin, Eugene V., Tatiana G. Senkevich, et Valerian V. Dolja. 2006. « The ancient Virus World and evolution of cells ». Biology Direct 1 (1): 29. https://doi.org/10.1186/1745-6150-1-29.
- Koonin, Eugene V., et Petro Starokadomskyy. 2016. « Are Viruses Alive? The Replicator Paradigm Sheds Decisive Light on an Old but Misguided Question ». Studies in History and Philosophy of Science Part C: Studies in History and Philosophy of Biological and Biomedical Sciences 59 (octobre): 125‑34. https://doi.org/10.1016/j.shpsc.2016.02.016.
- Kostyrka, Gladys. 2016. « What Roles for Viruses in Origin of Life Scenarios? » Studies in History and Philosophy of Science Part C: Studies in History and Philosophy of Biological and Biomedical Sciences 59 (octobre): 135‑44. https://doi.org/10.1016/j.shpsc.2016.02.014.
- Laidlaw, Patrick P. 2014. « Virus Diseases and Viruses ». Cambridge University Press. 2014. https://www.cambridge.org/us/academic/subjects/history/history-medicine/virus-diseases-and-viruses, https://www.cambridge.org/us/academic/subjects/history/history-medicine.
- Mahy, Brian W. J. 1998. Topley and Wilson’s Microbiology and Microbial Infections: Volume 1: Virology. Édité par Leslie Collier, Albert Balows, et Max Sussman. 9th Edition. London : New York: Hodder Education Publishers.
- Mahy, Brian W. J., et Marc H. V. van Regenmortel, éd. 2009. Desk Encyclopedia of Human and Medical Virology. 1st Edition. Amsterdam: Academic Press.
- Más, Vicente, et José A. Melero. 2013. « Entry of Enveloped Viruses into Host Cells: Membrane Fusion ». In Structure and Physics of Viruses: An Integrated Textbook, édité par Mauricio G. Mateu, 467‑87. Subcellular Biochemistry. Dordrecht: Springer Netherlands. https://doi.org/10.1007/978-94-007-6552-8_16.
- Metzner, Karin J. 2006. « Detection and Significance of Minority Quasispecies of Drug-Resistant HIV-1 ». Journal of HIV Therapy 11 (4): 74‑81.
- Mocali, Stefano, et Anna Benedetti. 2010. « Exploring Research Frontiers in Microbiology: The Challenge of Metagenomics in Soil Microbiology ». Research in Microbiology 161 (6): 497‑505. https://doi.org/10.1016/j.resmic.2010.04.010.
- Moreira, D., et P. Lopez-Garcia. 2009. « Ten Reasons to Exclude Viruses from the Tree of Life. Nat Rev Microbiol 7: 306-311 ». ResearchGate. 2009. https://www.researchgate.net/publication/24186117_Moreira_D_Lopez-Garcia_P_Ten_reasons_to_exclude_viruses_from_the_tree_of_life_Nat_Rev_Microbiol_7_306-311.
- Palese, Peter. 2006. « Making Better Influenza Virus Vaccines? – Volume 12, Number 1—January 2006 – Emerging Infectious Diseases Journal – CDC ». https://doi.org/10.3201/eid1201.051043.
- Podolsky, S. 1996. « The Role of the Virus in Origin-of-Life Theorizing ». Journal of the History of Biology. J Hist Biol. Spring 1996. https://doi.org/10.1007/BF00129697.
- Pradeu, Thomas. 2016. « Mutualistic viruses and the heteronomy of life ». Studies in History and Philosophy of Biological and Biomedical Sciences 59 (octobre): 80‑88. https://doi.org/10.1016/j.shpsc.2016.02.007.
- Rodrigues, C., M. Deshmukh, T. Jacob, R. Nukala, S. Menon, et A. Mehta. 2001. « Significance of HBV DNA by PCR over Serological Markers of HBV in Acute and Chronic Patients ». Indian Journal of Medical Microbiology 19 (3): 141‑44.
- Roossinck, Marilyn J. 2011. « The Good Viruses: Viral Mutualistic Symbioses ». Nature Reviews. Microbiology 9 (2): 99‑108. https://doi.org/10.1038/nrmicro2491.
- Ryan, Frank. 2009. Virolution. Collins.
- Rybicki, E. P. 1990. « The classification of organisms at the edge of life, or problems with virus systematics ». South African Journal of Science, no 86: 182–86.
- Sandbulte, Matthew R., Kim B. Westgeest, Jin Gao, Xiyan Xu, Alexander I. Klimov, Colin A. Russell, David F. Burke, Derek J. Smith, Ron A. M. Fouchier, et Maryna C. Eichelberger. 2011. « Discordant Antigenic Drift of Neuraminidase and Hemagglutinin in H1N1 and H3N2 Influenza Viruses ». Proceedings of the National Academy of Sciences 108 (51): 20748‑53. https://doi.org/10.1073/pnas.1113801108.
- Shors, Teri. 2016. Understanding Viruses. 3rd Edition. Burlington, Massachusetts: Jones & Bartlett Learning.
- Sinclair, John. 2008. « Human Cytomegalovirus: Latency and Reactivation in the Myeloid Lineage ». Journal of Clinical Virology, CMV Special Issue, 41 (3): 180‑85. https://doi.org/10.1016/j.jcv.2007.11.014.
- Suttle, Curtis A. 2007. « Marine Viruses–Major Players in the Global Ecosystem ». Nature Reviews. Microbiology 5 (10): 801‑12. https://doi.org/10.1038/nrmicro1750.
- Vetsigian, K., C. Woese, et N. Goldenfeld. 2006. « Collective Evolution and the Genetic Code ». Proceedings of the National Academy of Sciences of the United States of America. Proc Natl Acad Sci U S A. 11 juillet 2006. https://doi.org/10.1073/pnas.0603780103.
- Whitley, Richard J., et Bernard Roizman. 2001. « Herpes Simplex Virus Infections ». The Lancet 357 (9267): 1513‑18. https://doi.org/10.1016/S0140-6736(00)04638-9.
- Worobey, Michael, et Edward C. Holmes. 1999. « Evolutionary Aspects of Recombination in RNA Viruses ». The Journal of General Virology 80 ( Pt 10) (octobre): 2535‑43. https://doi.org/10.1099/0022-1317-80-10-2535.
- Wu, Katherine J. 2020. « There Are More Viruses than Stars in the Universe. Why Do Only Some Infect Us? » Science. 15 avril 2020. https://www.nationalgeographic.com/science/2020/04/factors-allow-viruses-infect-humans-coronavirus/.
- Yin, Yanbin, et Daniel Fischer. 2008. « Identification and investigation of ORFans in the viral world ». BMC Genomics 9 (janvier): 24. https://doi.org/10.1186/1471-2164-9-24.
- Zilinskas, R. A. 2017. « A Brief History of Biological Weapons Programmes and the Use of Animal Pathogens as Biological Warfare Agents ». Revue Scientifique Et Technique (International Office of Epizootics) 36 (2): 415‑22. https://doi.org/10.20506/rst.36.2.2662.
Sfetcu, Nicolae, « Qui a été le premier : le virus ou la cellule ? », SetThings (13 novembre 2020), DOI: 10.13140/RG.2.2.27284.53122, URL = https://www.telework.ro/fr/qui-a-ete-le-premier-le-virus-ou-la-cellule/
Email: nicolae@sfetcu.com
Cet article est sous licence Creative Commons Attribution-NoDerivatives 4.0 International. Pour voir une copie de cette licence, visitez http://creativecommons.org/licenses/by-nd/4.0/.

